เซลล์ปฐมภูมิและเซลล์ทุติยภูมิ
แบบฝึกหัด
เซลล์ปฐมภูมิและเซลล์ทุติยภูมิ
เซลล์ปฐมภูมิและเซลล์ทุติยภูมิ
เซลล์ปฐมภูมิและเซลล์ทุติยภูมิ
เนื้อหา
เซลล์ปฐมภูมิ
เซลล์กลับวานิกแบ่งออกเป็น 5 ชนิด คือ
- เซลล์แห้ง
- เซลล์แอลคาไลน์
- เซลล์ปรอท
- เซลล์เงิน
- เซลล์เชื้อเพลิง
เซลล์ถ่านไฟฉาย

เซลล์ถ่านไฟฉาย เป็นเซลล์ปฐมภูมิที่มีขนาดเล็ก เรียกอีกชื่อว่า เซลล์แห้ง (dry cell) ประกอบด้วย กล่องสังกะสีเป็นขั้วแอโนด และแท่งแกรไฟท์เป็นขั้วแคโทด และมี NH4Cl, ZnCl2, MnO2, ผงคาร์บอน แป้งเปียก และน้ำ ทำหน้าที่เป็นอิเล็กโทรไลต์เพื่อลดการรั่วของสาร
เกิดปฏิกิริยาดังนี้
- Anode :

- Cathode :

ปฏิกิริยารวม :

จากปฏิกิริยา Zn2+ ที่เกิดที่ขั้วแอโนดและ H2O กับ NH3 ที่เกิดขึ้นที่ขั้วแคโทด เกิดเป็นสารประกอบเชิงซ้อน คือ [Zn(NH3)4]2+, [Zn(NH3)2(H2O)2]2+ ซึ่งช่วยในการรักษาความเข้มข้นของ Zn2+ ไม่ให้สูงจนเกินไปจนเกิดการระเบิด และช่วยให้ค่าศักย์ไฟฟ้าเกือบคงที่เป็นเวลานานพอสมควร เมื่อใช้ไปเวลานาน ๆ สังกะสีจะเกิดการกร่อนทำให้ศักย์ไฟฟ้าค่อย ๆ ลดลงจนเป็นศูนย์ หรือเรียกว่าถ่านหมด
เซลล์แอลคาไลน์
เซลล์แอลคาไลน์ (Alkaline cell) มีส่วนประกอบคล้ายกับถ่านไฟฉายแต่จะใช้สารละลายเบส คือ KOH หรือ NaOH ผสมกับ MnO2 เป็นอิเล็กโทรไลต์
เกิดปฏิกิริยาดังนี้
- Anode :
![]()
- Cathode :

ปฏิกิริยารวม :
![]()
เซลล์นี้จะสามารถจ่ายไฟได้นานกว่าถ่านไฟฉาย เนื่องจากขั้วแคโทดที่เกิด OH- นั้นสามารถนำกลับไปใช้ที่ขั้วแอโนดได้อีกและขั้วสังกะสีผุกร่อนได้ช้ากว่าถ่านไฟฉาย
เซลล์ปรอท

เซลล์ปรอท (Mercury cell) มีส่วนประกอบคล้ายกับเซลล์แอลคาไลน์ แต่ใช้ HgO และเหล็กเป็นขั้วแคโทดเป็นขั้วแคโทด ใช้ Zn เป็นขั้วแอโนด ส่วนอิเล็กโทรไลต์จะประกอบด้วย KOH ผสมกับ Zn(OH)2
เกิดปฏิกิริยาดังนี้
- Anode :

- Cathode :

ปฏิกิริยารวม :
![]()
เซลล์ปรอทเป็นเซลล์ที่มีขนาดเล็ก ให้กระแสไฟฟ้าต่ำแต่จะให้ค่าศักย์ไฟฟ้าเกือบคงที่ตลอดอายุการใช้งาน นิยมใช้กับ นาฬิกาข้อมือ เครื่องคิดเลข กล้องถ่ายรูป เป็นต้น แต่เมื่อเสื่อมสภาพ ปรอทจะกำจัดยากและเป็นพิษ
เซลล์เงิน
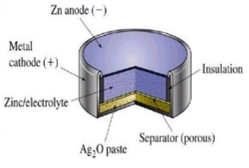
เซลล์เงิน (Silver cell) มีส่วนประกอบคล้ายกับเซลล์ปรอท คือ มี Zn เป็นขั้วแอโนด เหล็กและ Ag2O เป็นขั้วแคโทด ใช้อิเล็กโทรไลต์เหมือนกับเซลล์ปรอท
เกิดปฏิกิริยาดังนี้
- Anode :

- Cathode :
![]()
ปฏิกิริยารวม :
![]()
เซลล์เงินเป็นเซลล์ที่มีขนาดเล็ก อายุการใช้งานนาน แต่มีราคาแพง นิยมใช้กับ นาฬิกาข้อมือ กล้องถ่ายรูปอัตโนมัติ เครื่องช่วยฟัง เป็นต้น
เซลล์เชื้อเพลิง
เซลล์เชื้อเพลิง (Fuel cells) เป็นเซลล์กัลวานิกที่จ่ายไฟได้ตลอดเวลาไม่มีวันหมด เนื่องจากต้องเติมเชื้อเพลิงเข้าไปในเซลล์อย่างต่อเนื่องเพื่อให้เซลล์เกิดปฏิกิริยาตลอด เมื่อหยุดเติมเซลล์ก็จะหยุดทำงาน
เซลล์เชื้อเพลิงไฮโดรเจน-ออกซิเจน
เป็นเซลล์ที่ใช้แก๊สไฮโดรเจนและแก๊สออกซิเจนผ่านไปยังขั้วแคโทดและแอโนด โดยมีอิเล็กโทรไลต์เป็นสารละลายเบสคั่นระหว่างขั้วเพื่อฟ้องกันไม่ให้แก๊สทำปฏิกิริยากัน
ตัวอย่างของเซลล์นี้ เช่น
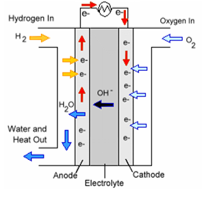
เซลล์เชื้อเพลิงแบบเบส เป็นเซลล์ที่มีประสิทธิภาพสูง นิยมใช้ในโครงการอวกาศ
ปฏิกิริยาที่เกิดขึ้นเป็นดังนี้
- Anode :
![]()
- Cathode :
![]()
ปฏิกิริยารวม :
![]()

เซลล์เชื้อเพลิงแบบเมมเบรนแลกเปลี่ยนโปรตอน ใช้แผ่นเมมเบรนเป็นอิเล็กโทไลต์ที่สามารถยอมให้ H+ เคลื่อนไปยังขั้วแคโทด ในขณะที่อิเล็กตรอนไหลผ่านวงจรไฟฟ้า ใช้ Pt เป็นตัวเร่งปฏิกิริยาในการแตกตัวของแก๊สไฮโดรเจนและการรวมตัวของโมเลกุลออกซิเจน ไฮโดรเจนไอออน และอิเล็กตรอน ข้อดี คือ มีขนาดเล็ก ไม่เกิดการกัดกร่อนและน้ำหนักเบา
เกิดปฏิกิริยาดังนี้
- Anode :
![]()
- Cathode :
![]()
ปฏิกิริยารวม :
![]()
เซลล์เชื้อเพลิงโพรเพน-ออกซิเจน

เกิดปฏิกิริยาดังนี้
- Anode :
![]()
- Cathode :
![]()
ปฏิกิริยารวม :
![]()
ปฏิกิริยาในเซลล์เชื้อเพลิงโพรเพน-ออกซิเจน นี้เสมือนกับปฏิกิริยาสันดาปของก๊าซโพรเพนเซลล์นี้ อาจให้ประสิทธิภาพการทำงานสูงประมาณ 2 เท่าของเครื่องยนต์สันดาปภายใน
เซลล์ทุติยภูมิ
เซลล์สะสมไฟฟ้าแบบตะกั่ว
เซลล์สะสมไฟฟ้าแบบตะกั่ว (Lead storage battery) ก่อนการใช้งานจะต้องมีการอัดไฟเข้าไปก่อนจึงจะสามารถจ่ายไฟได้ และเมื่อจ่ายไฟหมดแล้วก็สามารถอัดเข้าไปใหม่ได้อีก

ก่อนอัดไฟ : เซลล์สะสมไฟฟ้าแบบตะกั่วจะประกอบด้วยขั้ว Pb ทั้งสองขั้ว จุ่มอยู่ในสารละลายกรดซัลฟิวริก (H2SO4) จึงทำให้ค่าศักย์ไฟฟ้าเท่ากับ 0
อัดไฟครั้งแรก : เซลล์จะทำหน้าที่เป็นเซลล์อิเล็กโทรไลต์ โดยขั้วแอโนด (Pb) ทำปฏิกิริยากับ O2 เกิดเป็น PbO2 (s) ส่วนขั้วแคโทดจะเกิดแก๊ส H2 เขียนเป็นสมการ
รีดอกซ์ได้ดังนี้
- Anode (+) :
![]()
- Cathode (-) :
![]()
จ่ายไฟ : ขั้วแคโทด (PbO2) และขั้วแอโนด (Pb) จะกลายเป็น PbSO4 ส่วนกรด H2SO4 จะถูกใช้ไปและมีน้ำเกิดขึ้น ทำให้สารละลาย H2SO4 เจือจางลง
สามารถเขียนเป็นสมการได้ดังนี้
- Anode (-) :
![]()
- Cathode (+) :

อัดไฟครั้งที่ 2, 3, .....จนเสื่อม : เซลล์จะทำหน้าที่เป็นเซลล์อิเล็กโทรไลต์เหมือนการอัดไฟครั้งแรก แต่เกิดปฏิกิริยาต่างกัน
- Anode (+) :
![]()
- Cathode (-) :

เซลล์นิกเกิล - แคดเทียม
เซลล์นิกเกิล - แคดเทียม (Nickel – Cadmium cell) เรียกอีกอย่างว่า เซลล์นิแคด มีโลหะ Cd เป็นขั้วแอโนด NiO(OH) หรือ NiO2 เป็นขั้วแคโทด และใช้สารละลายเบสเป็นอิเล็กโทรไลต์ เมื่อมีการจ่ายไฟ

เกิดปฏิกิริยาดังนี้
- Anode :
![]()
- Cathode :

เมื่อจ่ายไฟหมดแล้วสามารถนำไปอัดไฟใหม่ได้ จะเกิดปฏิกิริยาตรงข้ามกับการจ่ายไฟ
- Anode :
![]()
- Cathode :

ข้อดี คือ เป็นเซลล์ที่มีขนาดเล็ก เก็บไว้ได้นานโดยไม่เสื่อมสภาพ ให้ศักย์ไฟฟ้าคงที่ และใช้งานได้นานกว่าเซลล์ไฟฟ้าแบบตะกั่ว
เซลล์ลิเทียม-ไอออนพอลิเมอร์
เซลล์ลิเทียม-ไอออนพอลิเมอร์ มี LiMnO4 หรือ LiCoO2 เป็นขั้วแอโนด แท่งแกรไฟต์เป็นขั้วแคโทด และมีอิเล็กโทรไลต์เป็นพอลิเมอร์ผสมกับเกลือลิเทียม เป็นเซลล์ที่มีระยะเวลาการใช้งานที่นานขึ้น และเก็บพลังงานได้นาน
เกิดปฏิกิริยาดังนี้
- Anode :
![]()
- Cathode :
![]()
ปฏิกิริยารวม :
![]()
เซลล์ชนิดนี้เป็นเซลล์ที่มีน้ำหนักเบา นิยมโทรศัพท์มือถือ คอมพิวเตอร์แบบพกพา