
คำนวณค่า pH ความเข้มข้นของให้ไฮโดรเนียมไอออนหรือไฮดรอกไซต์ไอออนของกรดและเบส
แบบฝึกหัด
EASY
คำนวณค่า pH ความเข้มข้นของให้ไฮโดรเนียมไอออนหรือไฮดรอกไซต์ไอออนของกรดและเบส
MEDIUM
คำนวณค่า pH ความเข้มข้นของให้ไฮโดรเนียมไอออนหรือไฮดรอกไซต์ไอออนของกรดและเบส
HARD
คำนวณค่า pH ความเข้มข้นของให้ไฮโดรเนียมไอออนหรือไฮดรอกไซต์ไอออนของกรดและเบส
เนื้อหา
เนื่องจากค่า pH และ pOH ของสารละลายมีความสัมพันธ์กับ [H3O+] และ [OH-]
ดังสมการ
โดยที่ pH + pOH = 14 ซึ่งความสัมพันธ์ดังกล่าวได้มาจากการแตกตัวของน้ำแสดงดังปฏิกิริยา
![]()
ค่าคงที่ของการแตกตัวของน้ำ (Kw) ที่ 25 oC เท่ากับ 1.0 x 10-14
จาก

ทำให้ pH ของน้ำเท่ากับ 7 และ สามารถกำหนดสเกลของค่า pH ในการระบุความเป็นกรด-เบสของสารละลายได้ดังนี้
คือ pH = 7 เป็นกลาง pH < 7 เป็นกรด และ pH > 7 เป็นเบส ทำให้มีการกำหนดค่า pH ตั้งแต่ 0-14
ในการคำนวณ pH ของสารละลายกรด-เบส ต้องคำนวณหา [H3O+] และ [OH-] ของสารละลายก่อน ซึ่งขึ้นกับชนิดของกรดและเบส กรดแก่และเบสแก่เกิดการแตกตัวให้ H3O+ และ OH_ 100 % ทำให้ความเข้มข้นของไอออนดังกล่าวเท่ากับความเข้มข้นเริ่มต้น

เช่น คำนวณหา pH ของสารละลาย HCl ความเข้มข้น 0.10 M ดังนั้น [H3O+] เท่ากับ 0.10 M
เนื่องจาก HCl เป็นกรดแก่ ค่า pH = -log 0.1= 1 ส่วนการคำนวณหา pH ของสารละลาย NaOH ความเข้มข้น 0.10 M
ดังนั้น [OH-] เท่ากับ 0.10 M เนื่องจาก NaOH เป็นเบสแก่ ค่า pOH = -log 0.10 = 1 และ ค่า pH = 14-1 = 13
ในการคำนวณ pH ของสารละลายกรดอ่อนและเบสอ่อน
เนื่องจากการแตกตัวของกรดอ่อนและเบสอ่อน จะมีค่าไม่เท่ากับความเข้มข้นเริ่มต้นของกรดอ่อนและเบสอ่อน เนื่องจากแตกตัวเพียงบางส่วน ทำให้ต้องนำค่า Ka และ Kb ที่ขึ้นกับชนิดของกรดอ่อนและเบสอ่อนมาคำนวณหา [H3O+] และ [OH-]
ดังสมการ

สมการดังกล่าว เป็นวิธีประมาณค่าการแตกตัวของกรดอ่อนหรือเบสอ่อนเกิดขึ้นน้อยมาก ดังนั้น จึงต้องมีการคำนวณหาร้อยละของการแตกตัว (% ionization; %)
ซึ่งคำนวณได้จาก

ถ้า % < 5 ใช้วิธีประมาณได้ ในการคำนวณหา [H3O+] และ [OH-] ดังสมการข้างต้น
แต่ถ้า % 5 ไม่สามารถใช้การประมาณค่าได้แสดงว่ากรดอ่อนหรือเบสอ่อนมีการแตกตัวได้มาก ต้องทำการจัดสมการของ Ka หรือ Kb ให้อยู่ในรูปของสมการ Quadratic equation
ax2 + bx + c = 0 และแก้สมการ
โดย
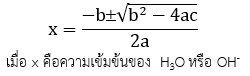
เช่น คำนวณหา pH ของสารละลาย CH3COOH ความเข้มข้น 0.10 M กำหนดค่า Ka เท่ากับ 1.8 x 10-5

![]()
= 1.3 < 5% ใช้วิธีประมาณได้
ดังนั้น pH = -log 1.3 x 10-3 = 2.9